Konjugovaný systém v chémii: definícia, vlastnosti a príklady
Konjugovaný systém v chémii — definícia, vlastnosti a príklady. Objavte, ako delokalizované π-elektróny zvyšujú stabilitu, vodivosť a reaktivitu molekúl.
V chémii je konjugovaný systém systém spojených p-orbitálov s delokalizovanými elektrónmi. Konjugované systémy sú tvorené niekoľkými viacnásobnými väzbami, z ktorých každá je oddelená jednoduchými väzbami (striedanie =C–C–C=C alebo v rozšírenej forme aj kombinácia dvojitých väzieb a voľných elektronových párov). Vo všeobecnosti konjugácia znižuje celkovú energiu molekuly a zvyšuje jej stabilitu. Do konjugovaného systému môžu prispievať aj osamelé páry, radikály alebo karbéniové ióny – elektróny týchto centier môžu byť delokalizované cez sústavu p-orbitálov. Zlúčenina môže byť cyklická, acyklická, lineárna alebo zmiešaná. Vo väčšine prípadov sú atómy v molekule držané pohromade jednoduchými väzbami (kde sa orbitály zo susedných atómov prekrývajú). Molekuly, ktoré majú konjugovaný systém, majú vlastnosti odlišné od izolovaných (nekonjugovaných) dvojitých väzieb – pri delokalizácii sa mení reaktivita, spektrálne vlastnosti a elektrická vodivosť.
Mechanizmus konjugácie a delokalizácie
Konjugácia vzniká prekrývaním jedného p-orbitálu s druhým cez sigma väzbu (alebo jednoduchú väzbu), ktorá sa medzi nimi nachádza. Prekrývanie umožňuje tvorbu systému π-orbitálov rozprestierajúcich sa cez viaceré atómy. (Do konjugovaného systému môžu prispievať aj d-orbitály väčších atómov, napr. v niektorých prechodných kovoch alebo ťažších heteroatómoch.)
Konjugovaný systém má oblasť prekrývajúcich sa p-orbitálov, ktoré „premosťujú“ jednoduché väzby medzi nimi. To umožňuje delokalizáciu π-elektrónov cez všetky susedné zarovnané p-orbitály – elektróny π teda nepatria jednej väzbe alebo atómu, ale skupine atómov (systému). Táto delokalizácia je často zobrazená pomocou rezonančných štruktúr, ktoré sú len čiastočnými príspevkami k reálnej elektronovej hustote molekuly.
Vlastnosti konjugovaných systémov
- Stabilita: Delokalizácia znižuje vnútornú energiu molekuly, čo vedie k termodynamickej stabilizácii (príklad: benzén je stabilnejší než očakávaná nekonjugovaná štruktúra s tromi izolovanými dvojitými väzbami).
- Elektronická štruktúra: Konjugácia znižuje energiu HOMO–LUMO gap (energetický rozdiel medzi najvyššie obsadeným a najnižšie prázdnym molekulovým orbitálom), čo ovplyvňuje farbu a elektrickú vodivosť.
- Spektrálne vlastnosti: Predĺžená konjugácia posúva absorpčné pásy v UV–Vis spektre na dlhšie vlnové dĺžky (červený posun). Toto vysvetľuje, prečo majú mnohé pigmenty a farbivá dlhé farebné absorpčné pásy.
- Reaktivita: Konjugované systémy často podliehajú špecifickým reakciám (napr. 1,4-addícia u dienov, aromatické substitúcie u aromátov) a stabilizujú reakčné medziprodukty (karbokationty, radikály), čím menia kinetiku i mechanizmy reakcií.
- Elektrická vodivosť: Rozsiahle konjugované systémy môžu viesť k vodivým alebo polovodivým vlastnostiam (vodivé polyméry, grafén, uhlíkové nanorúrky).
Typy konjugácie
- Lineárna konjugácia – striedanie jednoduchých a dvojitých väzieb v reťazci (napr. 1,3-butadién).
- Cyklická konjugácia – keď sa p-orbitály konjugujú v kruhu; ak je splnené pravidlo Hückela (4n+2 π-elektrónov), molekula môže byť aromatická (napr. benzén).
- Krížová (cross) konjugácia – systém, kde sa konjugácia delí na dve odbočky, ktoré nie sú navzájom priamo prepojené (napr. vinylénové alebo niektoré dienylové systémy); správanie pri rezonancii a reaktivite sa líši od lineárnej konjugácie.
- Konjugácia s heteroatómami – osamelé páry na atómoch ako O, N, S môžu vstupovať do konjugácie a ovplyvňovať elektronickú hustotu celej sústavy (napr. anilín, furan).
- Hyperkonjugácia – súvisí s interakciou σ (C–H alebo C–C) orbitalov s prázdnymi alebo π-orbitálmi; nie je to priamy systém p–p prekrývania, ale tiež prispieva k stabilizácii (napr. stabilizácia terciárnych karbokationtov).
Rezónancia, aromatickosť a pravidlo Hückela
Rezónancia je koncept, ktorým sa vyjadruje delokalizácia elektrónov: skutočná elektronová štruktúra je superpozíciou všetkých rezonančných štruktúr. Aromatické systémy (ako benzén) majú zvláštnu stabilitu vďaka úplne delokalizovaným π-elektrónom po kruhu. Podľa Hückelovho pravidla sú kruhové plánarne systémy s (4n+2) π-elektrónmi aromatické a výrazne stabilizované; systémy so 4n π-elektrónmi môžu byť antiaromatické a destabilizované.
Príklady konjugovaných zlúčenín
- 1,3-Butadién – jednoduchý lineárny dikonjugovaný systém, dôležitý v polymerizácii (guma).
- Benzén – klasický príklad aromatickej delokalizácie; stabilita vysvetľuje jeho reakcie (elektrofílná aromatická substitúcia namiesto jednoduchých adícií).
- Beta-karotén – rozsiahly konjugovaný polyén, ktorý absorbuje viditeľné svetlo a je pigmentom oranžovej farby.
- Vodivé polyméry (polyanilín, polythiophene) – konjugované reťazce, ktoré po dopingovaní vedú prúd.
- Grafit, vodivé polyméry a uhlíkové nanorúrky – príklady veľmi rozsiahlych konjugovaných systémov s výnimočnými elektrickými a mechanickými vlastnosťami.
Vplyv na analytické metódy
Konjugované systémy sa ľahko detekujú a charakterizujú pomocou viacerých techník:
- UV–Vis spektroskopia – pozoruje sa presun absorpcie na dlhšie vlnové dĺžky s rastúcou dĺžkou konjugácie.
- NMR spektroskopia – delokalizácia ovplyvňuje chemické posuny (napr. aromatické posuny protonov v benzéne sú špecifické).
- Röntgenová difrakcia / rentgenovská kristalografia – ukáže vyrovnanosť väzbových dĺžok v delokalizovaných kruhoch.
- Elektronová spektroskopia – informuje o rozložení molekulárnych orbitálov a prechodoch medzi nimi.
Dôsledky pre reaktivitu a syntézu
Konjugácia mení preferované reakčné mechanizmy a stabilizuje medziprodukty (napr. allylový karbokation je stabilizovaný delokalizáciou). Pri navrhovaní organických látok (farbív, liečív, materiálov pre organickú elektroniku) sa konjugácia využíva na prispôsobenie optických a elektronických vlastností (napr. posun absorpcie do viditeľného spektra, zníženie HOMO–LUMO gaps pre kondenzáciu nabitosti a transport elektrónov).
Krátke zhrnutie
- Konjugovaný systém = séria prepojených p-orbitálov umožňujúcich delokalizáciu π-elektrónov.
- Delokalizácia prináša stabilitu, mení spektrálne a elektrické vlastnosti a ovplyvňuje reaktivitu.
- Významné príklady zahŕňajú benzén, polyény, vodivé polyméry, grafit a uhlíkové nanorúrky.
Najväčšie konjugované systémy (s najväčším počtom spoločných elektrónov) sú v grafite, vodivých polyméroch a uhlíkových nanorúrkach. Tieto materiály ukazujú, ako rozsiahla konjugácia vedie k unikátnym mechanickým, tepelným a elektrickým vlastnostiam využívaným v priemysle a výskume.

Cinnamaldehyd, typ fenolovej zlúčeniny s konjugovaným systémom
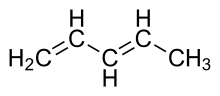
1,3-pentadién
Mechanizmus
Konjugáciu môžu spôsobiť rôzne typy molekulárnych štruktúr. Pri konjugácii musia mať všetky susedné atómy v reťazci voľný p-orbitál. V mnohých prípadoch sú konjugované systémy radom jednoduchých väzieb, za každou z nich nasleduje dvojitá väzba. Existujú aj iné systémy. Napríklad furán (pozri obrázok) je päťčlenný kruh s dvoma striedajúcimi sa dvojitými väzbami a kyslíkom v polohe 1. Kyslík vo furáne má dva osamelé páry, z ktorých jeden vypĺňa p-orbitál na tejto pozícii. Osamelý elektrónový pár umožňuje konjugáciu v päťčlennom kruhu. Prítomnosť dusíka v kruhu môže byť zdrojom pi orbitálov potrebných na konjugáciu. Orbitály pi potrebné na konjugáciu môžu pochádzať aj zo substitučných skupín α na kruhu, ako sú: karbonylová skupina (C=O), imínová skupina (C=N), vinylová skupina (C=C) alebo anión.
Chromofóry
Konjugované systémy sú hlavnou súčasťou chromofórov. Chromofory sú časti molekuly pohlcujúce svetlo, ktoré môžu spôsobiť, že zlúčenina má viditeľnú farbu. Chromofory sú často prítomné v rôznych organických zlúčeninách a niekedy sú prítomné v polyméroch, ktoré sú farebné alebo svietia v tme. Chromofory často pozostávajú zo série konjugovaných väzieb a/alebo kruhových systémov, ktoré môžu obsahovať väzby C-C, C=C, C=O alebo N=N. Chromofóry majú mnohokrát aromatické kruhy.
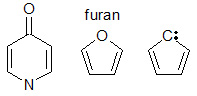
Konjugácia s rôznymi druhmi p-orbitálnych donorských skupín
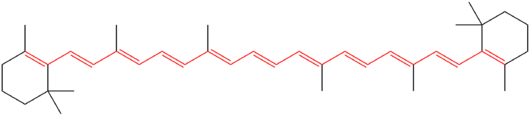
Chemická štruktúra betakaroténu. Jedenásť konjugovaných dvojitých väzieb, ktoré tvoria chromofór molekuly, je zvýraznených červenou farbou.
Bežné príklady
Súvisiace stránky
- Rezonancia (chémia)
- Hyperkonjugácia
- Krížová konjugácia
- Polyén
Otázky a odpovede
Otázka: Čo je v chémii konjugovaná sústava?
Odpoveď: Konjugovaný systém je systém spojitých a paralelných p-orbitálov s delokalizovanými elektrónmi.
Otázka: Ako vznikajú konjugované systémy?
Odpoveď: Konjugované systémy sú vytvorené niekoľkými viacnásobnými väzbami, z ktorých každá je oddelená jednoduchou väzbou.
Otázka: Čo všetko sa môže nachádzať v konjugovanom systéme?
Odpoveď: Konjugované systémy môžu obsahovať osamelé páry, radikály alebo karbonové ióny.
Otázka: Môže byť zlúčenina s konjugovaným systémom cyklická?
Odpoveď: Áno, zlúčenina s konjugovaným systémom môže byť cyklická, acyklická, lineárna alebo zmiešaná.
Otázka: Aké sú jedinečné vlastnosti molekúl s konjugovaným systémom?
Odpoveď: Molekuly s konjugovaným systémom majú jedinečné vlastnosti odlišné od bežných zlúčenín, ktoré vznikajú vďaka zdieľaniu delokalizovaných elektrónov medzi mnohými atómami.
Otázka: Aké prekrývanie je súčasťou konjugácie?
Odpoveď: Konjugácia je prekrývanie jedného p-orbitalu s druhým cez sigma väzbu (alebo jednoduchú väzbu), ktorá sa nachádza medzi nimi.
Otázka: Kde sa nachádzajú najväčšie konjugované systémy?
Odpoveď: Najväčšie konjugované systémy (s najväčším počtom spoločných elektrónov) sa nachádzajú v grafite, vodivých polyméroch a uhlíkových nanorúrkach.
Prehľadať