Génová terapia: princíp, vektorové metódy a liečba (Glybera)
Génová terapia: princíp, vektorové metódy a Glybera — ako vírusné vektory opravujú gény, liečia vzácnu pankreatitídu a menia modernú medicínu.
Génová terapia znamená, že človeku, ktorý má poškodený gén, sa vloží funkčný gén. Ide zväčša o liečbu somatických buniek (t. j. buniek tela), nie zárodočných buniek — teda zmeny sa nededia na potomstvo. Európska komisia udelila povolenie na použitie jednej konkrétnej génovej terapie v EÚ: lieku Glybera, ktorý využíva vírus ako nosič (vektor) na dodanie funkčnej kópie génu do svalových buniek. Glybera (alipogene tiparvovec) dostala povolenie na uvedenie na trh, čo teoreticky znamenalo možnosť predaja v celej EÚ; z praktických dôvodov (veľmi vysoká cena a nízky dopyt) však výrobca liek neskôr stiahol z trhu (komerčné stiahnutie v roku 2017).
Princíp génovej terapie
Cieľom génovej terapie je nahradiť alebo opraviť chýbajúcu či chybnú génovú funkciu vložením funkčnej kópie génu, potlačením škodlivého génu alebo úpravou génovej aktivity (napr. pomocou techník génovej editácie). Terapia môže byť podaná priamo do pacienta (in vivo) alebo sa bunky najprv upravia mimo tela a potom vrátia späť (ex vivo).
Prečo Glybera – dedičný nedostatok lipázy
Jeden z milióna ľudí má defekt v géne pre lipázu (konkrétne lipoproteínovú lipázu, LPL), enzým potrebný na rozklad tukov. Tento stav (LPL deficientná hypertriglyceridémia) vedie k hromadeniu tukových častíc v krvi, častým bolestivým zápalom pankreasu (akútnej pankreatitíde) a môže byť život ohrozujúci. Doteraz bol hlavným spôsobom manažmentu prísna diéta s veľmi nízkym obsahom tukov a podporná liečba pri akútnych záchvatoch.
Vektorové metódy a rozdiely v prístupoch
Pri génovej terapii sa často používa vírus ako vektorom. Vírus je pre bunky prirodzený „doručovateľ“ genetického materiálu: gén je vložený do vírusového genómu a vírus následne prenesie tento gén do ľudských buniek. Dôležité je rozlíšiť pojmy: pri nepriamom vložení nukleových kyselín bez použitia živého vírusu sa obyčajne hovorí o transfekcii, zatiaľ čo pri použití vírusového nosiča je presnejší termín „transdukcia“. Táto technika sa líši od techniky génového knokautu, pri ktorej sa nepoužíva vírusový vektor, ale často sa cielene vyraďuje funkcia konkrétneho génu (príkladom sú metódy génovej editácie typu CRISPR/Cas).
Existujú dva základné prístupy: doplniť funkčný gén (genová suplementácia) alebo opraviť/generovať zmenu priamo v existujúcom géne (génová editácia). V praxi sa volí spôsob podľa choroby, typu cieľovej bunky a požadovanej trvania účinku.
Typy vírusových a nevírusových vektorov
- Adenovírusové vektory: efektívne pri krátkodobej expresii, môžu spôsobiť silnú imunitnú odpoveď.
- Adeno-asociované vírusy (AAV): relatívne bezpečné, nízka imunogenicita, často nepoužívajú integráciu do genómu (transgén pretrváva epitermálne), vhodné pre dlhodobú expresiu v postmitotických tkanivách. Glybera používala AAV1 sérotyp na intramuskulárne injekcie.
- Lentivírusy (napr. HIV-založené vektory): integrujú sa do genómu bunky, čo umožňuje dlhodobú expresiu, ale so sebou nesie riziko inzercie do kritických génových oblastí.
- Nevírusové metódy: lipozómy, nanoparticle, elektroportácia alebo priamy prenos DNA — tieto metódy znižujú riziko vírusových reakcií, no často majú nižšiu efektivitu vstupu do buniek.
Prípad Glybera – konkrétne riešenie a jeho limity
Glybera obsahovala variant géna LPL (S447X), ktorý bol vložený do AAV1 vektora a podával sa sériou intramuskulárnych injekcií. Cieľom bolo zvýšiť aktivitu LPL v mieste aplikácie a tým znížiť hladinu triglyceridov a počet záchvatov pankreatitídy. Klinické štúdie ukázali, že u niektorých pacientov došlo k zlepšeniu, avšak efektivita bola variabilná a počet pacientov s touto veľmi zriedkavou chorobou bol malý.
Hlavné dôvody, prečo sa Glybera komerčne neuchytila, boli extrémne vysoká cena (hoci presné ceny sa líšili, často sa spomínal rad okolo jedného milióna eur za pacienta), obmedzený trh a logistické/nákladové nároky na podanie. Výrobca ju preto z obchodného obehu stiahol.
Riziká, monitorovanie a regulačné otázky
- Riziká zahŕňajú imunitnú odpoveď proti vektoru alebo transgénu, ktorá môže znížiť účinnosť alebo spôsobiť zápal.
- Inzercia do genómu (u integrujúcich vektorov) môže viesť k aktivácii onkogénov alebo deaktivácii tumor-supresorov (inzercná mutagenéza).
- Dlhodobé sledovanie pacientov je nevyhnutné — regulátory požadujú postmarketingové štúdie na monitorovanie bezpečnosti a trvania účinku.
- Etické a spoločenské otázky zahŕňajú prístup k drahým terapiám, spravodlivé rozdelenie liekov a rozdiely medzi somatickou a zárodočnou terapiou.
Budúcnosť génovej terapie
Génová terapia sa rýchlo rozvíja: nové vektory s lepšou cieľovou špecificitou, bezpečnejšie editovacie nástroje (CRISPR/Cas systémy s nižším off-target efektom), a pokročilé nevírusové doručovacie systémy zvyšujú potenciál liečby dedičných aj získaných ochorení. Rozvoj cien a modelov úhrady (napr. platba za výsledok) môže tiež rozhodnúť o širšom uplatnení týchto liekov v klinickej praxi.
Génová terapia nie je univerzálne riešenie, ale pri správnom výbere ochorenia, vektora a kontrolovaní rizík môže priniesť zásadné zlepšenie pre pacientov s doteraz nevyliečiteľnými genetickými ochoreniami.
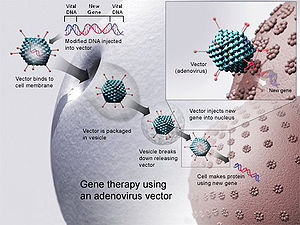
Génová terapia pomocou adenovírusového vektora. Nový gén sa vloží do vírusu, ktorý sa potom vloží do človeka. Ak je liečba úspešná, nový gén vytvorí funkčný enzým, ktorý lieči ochorenie.
Čína
Čína bola prvou krajinou, ktorá v roku 2003 schválila komerčnú výrobu génovej terapie. Táto génová terapia je určená na liečbu skvamocelulárneho karcinómu hlavy a krku (HNSCC) - rakoviny, ktorá sa v Číne vyskytuje v 10 % nových prípadov rakoviny. V Číne je každoročne 2,5 milióna nových pacientov s rakovinou.
Prvá komerčná génová terapia na svete, ktorá sa predáva pod obchodným názvom Gendicine, tiež využíva vírus na vloženie génu do ľudského genómu.
Minulosť
O možnosti génovej terapie sa začalo hovoriť hneď, ako boli známe úlohy DNA a RNA. Prvá konkrétna publikácia sa objavila v roku 1972.
Budúcnosť
Mnoho ďalších typov génovej terapie je v štádiu skúšania. Je zrejmé, že cyklus udalostí bude súčasťou budúcej klinickej medicíny: Génová terapia alebo vyradenie génov z činnosti: analýza sekvencie DNA > identifikácia chybných génov > oprava génov pomocou génovej terapie alebo vyradenia génov. Niekedy sa vyskytnú problémy s vedľajšími účinkami; tie sa môžu objaviť vo fáze skúšania. V súčasnosti existuje databáza, ktorá obsahuje zoznam všetkých známych klinických skúšok.
Otázky a odpovede
Otázka: Čo je to génová terapia?
Odpoveď: Génová terapia je proces vloženia funkčného génu, ktorý nahradí poškodený gén u pacienta.
Otázka: Aký výrobok Európska komisia schválila na génovú terapiu?
Odpoveď: Európska komisia schválila výrobok Glybera na génovú terapiu.
Otázka: Ako Glybera lieči genetickú poruchu?
Odpoveď: Glybera používa vírus na infikovanie svalových buniek funkčnou kópiou génu na liečbu genetickej poruchy.
Otázka: Čo je to gén lipáza a prečo je dôležitý?
Odpoveď: Gén lipáza je gén potrebný na rozklad tukov. Je dôležitý, pretože poškodené kópie tohto génu môžu spôsobiť hromadenie tukov v krvi, čo vedie k pankreatitíde, ktorá ohrozuje život.
Otázka: Akú techniku používa spoločnosť Glybera na génovú terapiu?
Odpoveď: Spoločnosť Glybera používa techniku transfekcie, pri ktorej vírusový vektor vkladá gén do ľudských buniek.
Otázka: Čo je to vírusový vektor?
Odpoveď: Vírusový vektor je nosič, ktorý prenáša genetický materiál do buniek.
Otázka: Ako sa technika transfekcie líši od techniky génového knockoutu?
Odpoveď: Technika transfekcie zahŕňa použitie vírusového vektora na vloženie funkčnej kópie génu, zatiaľ čo technika vyradenia génu nepoužíva vírusový vektor. Cieľom techniky génového knockoutu je odstrániť alebo znefunkčniť gén.
Prehľadať