Molekulové vibrácie
Molekulové vibrácie sú jedným z troch rôznych druhov pohybu molekúl, ktoré zahŕňajú translačný pohyb (keď sa celá molekula pohybuje rovnakým smerom) a rotačný pohyb (keď sa molekula otáča ako vrchol).
Vibračný pohyb molekuly nastáva vtedy, keď sa pohybujú väzby medzi atómami v molekule. Predstavte si atómy ako okrúhle guľôčky, ktoré sú spojené pružinou, ktorá sa môže natiahnuť tam a späť. Príkladom tohto pohybu je "naťahovanie", ktoré je najjednoduchším príkladom vibrácie pre molekulu a vyskytuje sa len medzi dvoma atómami. Medzi takéto príklady molekúl patria vodík H2 , dusík N2 a kyslík O . 2
Typy vibrácií
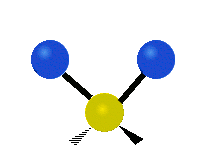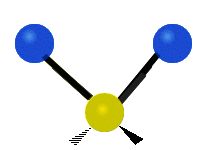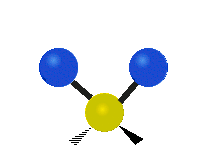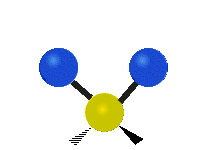
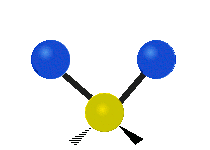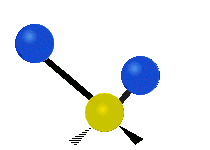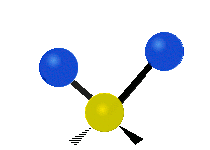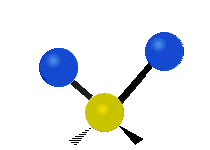
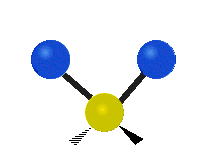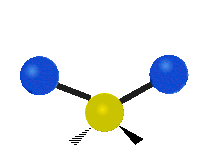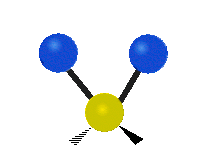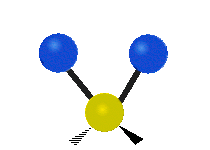
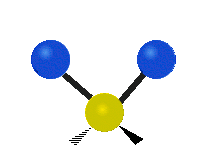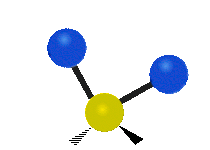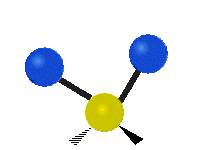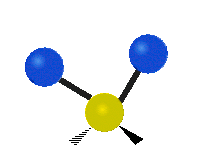
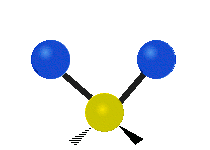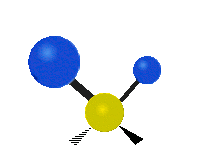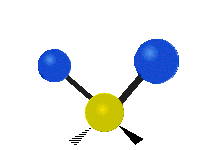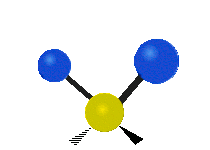
Ak má molekula viac ako dva atómy, situácia sa komplikuje. Predpokladajme, že sa pridá len jeden ďalší atóm, takže teraz máme tri atómy ako vo vode H2 O, kde sú oba atómy vodíka pripojené k centrálnemu atómu kyslíka. Pamätajte si, že pri vodíku bol jeden druh rozťahovania, ale vo vode sú dva druhy rozťahovania a štyri ďalšie druhy vibrácií nazývané ohybové vibrácie, ako je znázornené nižšie.
Atómy v skupine CH2 alebo v molekulách, ako je voda, môžu vibrovať šiestimi rôznymi spôsobmi: symetrickým a antisymetrickým rozťahovaním, nožnicovým rozťahovaním, kolísaním, kmitaním a krútením:
| Symetrické naťahovanie | Antisymetrické naťahovanie | Nožnicové nožnice |
|
|
|
|
| Hojdanie | Wagging | Twisting |
|
|
|
|
symetrické rozťahovanie: keď sa dva pripojené atómy súčasne vzďaľujú a približujú k centrálnemu atómu.
antisymetrické rozťahovanie: Keď sa dva pripojené atómy nepohybujú súčasne smerom od centrálneho atómu a k nemu.
nožnice: Tak ako hovorí názov, nožnice sa pohybujú, keď sa dva atómy od seba vzďaľujú a približujú sa k sebe.
kolísanie: Tento pohyb je ako kyvadlo na hodinách, ktoré sa pohybuje tam a späť, len tu je kyvadlom atóm a namiesto jedného sú tu dva.
vŕzganie: Ak si človek podrží ruku pred sebou a položí dva prsty do tvaru písmena "V" a ohne zápästie smerom k sebe a od seba. Konce prstov sú tu pripojené atómy a zápästie je centrálny atóm.
krútenie: Tento pohyb je, akoby človek chodil po bežiacom páse, kde jeho pás je centrálnym atómom a nohy sú dva pripojené atómy.
Molekuly s viac ako tromi atómami
Molekuly s viac ako tromi atómami sú ešte zložitejšie a majú ešte viac vibrácií, ktoré sa niekedy nazývajú "vibračné módy". Každý nový vibračný mód je v podstate inou kombináciou šiestich vyššie uvedených. Čím viac atómov je v molekule, tým viac spôsobov sa dá kombinovať. Pre väčšinu molekúl s N atómami je počet možných vibrácií pre danú molekulu 3N - 6, zatiaľ čo lineárne molekuly alebo molekuly, v ktorých sú atómy v priamke, majú 3N - 5 vibračných módov.
Vzťah energie a vibrácií
Newtonova mechanika
Pomocou newtonovskej mechaniky možno vibrácie molekuly vypočítať tak, že sa väzby považujú za pružiny. Je to užitočné, pretože podobne ako pružina, aj väzba potrebuje energiu na roztiahnutie a tiež energiu na stlačenie. Energia potrebná na roztiahnutie alebo stlačenie väzby závisí od tuhosti väzby, ktorá je reprezentovaná konštantou pružiny k, a redukovanej hmotnosti alebo "stredu hmotnosti" dvoch atómov pripojených na oboch koncoch označených μ. Vzorec, ktorý sa používa na vyjadrenie energie potrebnej na vyvolanie vibrácie vo väzbe, je nasledovný:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \nad {2\pi }}{\sqrt {k \nad \mu }}.\! }
h: je Planckova konštanta
ν: je frekvencia a predstavuje rýchlosť, akou sa väzba stláča a opäť rozťahuje. Čím je ν väčšia, tým je táto rýchlosť rýchlejšia.
Ε: je energia potrebná na stlačenie a stiahnutie väzby.
μ: Redukčná hmotnosť je súčinom dvoch hmotností atómov a ich súčtu:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \over m_{1}+m_{2}}.\! }
Kvantová mechanika
Pri použití kvantovej mechaniky je vzorec, ktorý opisuje pružinu, presne rovnaký ako verzia Newtonovej mechaniky, s výnimkou toho, že sú povolené len určité energie alebo energetické hladiny. Predstavte si energetické úrovne ako stupne na rebríku, kde človek môže vystúpiť alebo zostúpiť vždy len po jednej priečke. Rovnako ako táto osoba nemôže stáť na priestore medzi priečkami, tak ani väzba nemôže mať energiu medzi energetickými úrovňami. Tento nový vzorec sa stáva:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \over 2}\right){1 \over {2\pi }}{\sqrt {k \over m}}}! } 
kde n je kvantové číslo alebo "energetická hladina", ktorá môže nadobúdať hodnoty 0, 1, 2 ... Tvrdenie, že energetické hladiny môžu naraz stúpať alebo klesať len o jednu hladinu, je známe ako výberové pravidlo, ktoré hovorí, že jediné povolené prechody medzi energetickými hladinami sú:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
kde \Delta n je energetický prechod.
Aplikácie vibračných pohybov
Keď svetlo určitej frekvencie dopadne na molekulu, ktorá má vibrácie, ktorých pohyb zodpovedá rovnakej frekvencii, potom sa svetlo absorbuje do molekuly a energia svetla spôsobí, že sa väzby pohybujú v tomto špecifickom vibračnom pohybe. Kontrolou svetla, ktoré sa absorbuje, vedci môžu zistiť, či sa v nej nachádza určitý druh molekulovej väzby, a porovnať ju so zoznamom molekúl, ktoré majú túto väzbu.
Niektoré molekuly, ako napríklad hélium a argón, majú len jeden atóm a nemajú žiadne väzby. To znamená, že neabsorbujú žiadne svetlo tak, ako to dokáže molekula s viac ako jedným atómom.
Medzi špecifické oblasti chémie, ktoré využívajú pri svojich štúdiách molekulové vibrácie, patrí infračervená spektroskopia (IR) a Ramanova spektroskopia (Raman), pričom IR je viac využívaná a má tri vlastné podoblasti. Tieto podoblasti sú známe ako blízka IR, stredná IR a ďaleká IR spektroskopia. Nasleduje všeobecný zoznam týchto oblastí a reálnych aplikácií
Blízke IR: kvantitatívne stanovenie druhov, ako sú proteíny, tuky, uhľovodíky s nízkou molekulovou hmotnosťou a voda. Ďalšie využitie sa získava v poľnohospodárskom, potravinárskom, ropnom a chemickom priemysle
Stredná IR: Najobľúbenejšia z IR oblastí, používa sa na určovanie štruktúry organických a biochemických zlúčenín.
Ďaleká infračervená oblasť: táto oblasť je menej populárna, hoci našla využitie v anorganických štúdiách
Raman: Ramanove žiarenie sa používa na kvalitatívne a kvantitatívne štúdium anorganických, organických a biologických systémov, často ako doplnková technika k IR.
Prehľadať