Cheletropické reakcie: definícia, mechanizmus a príklady
Cheletropické reakcie – prehľad definície, mechanizmu a príkladov: ako vznikajú dve nové väzby na jednom atóme, hnacie faktory (CO, N2) a ilustratívne príklady.
Cheletropické reakcie sú špecifickým typom pericyklických reakcií, pri ktorých jeden atóm na jednom z činidiel vzniká súčasne dve nové väzby. Pericyklická reakcia sa vyznačuje prechodným stavom s cyklickým usporiadaním atómov a zodpovedajúcim cyklickým usporiadaním interagujúcich orbitálov; v tomto poli dochádza k reorganizácii väzieb σ a π. Cheletropické reakcie tvoria podtriedu cykloadícií, ale špecifickým znakom je, že obe nové väzby vznikajú na ten istý atóm jedného z reagujúcich činidiel.
Mechanizmus a orbitalne aspekty
Všeobecne prebiehajú cheletropické reakcie concertedne (jednostupňovo) ako pericyklický proces, hoci niekedy môžu prebiehať aj cez krokové (radikálové alebo iónové) mechanizmy v závislosti od povahy činidiel a podmienok. Interakcia je často zrozumiteľná pomocou Frontier Molecular Orbital (FMO) prístupu: malé činidlo (napr. karben, SO2 alebo iný heteroatómový fragment) poskytuje orbitál, ktorý sa súčasne viaže na π-systém partnera tak, že sa vytvoria dve väzby na rovnaký atóm.
Symetria orbitálov rozhoduje o tom, či je proces termálne alebo fotochemicky povolený podľa pravidiel Woodwarda–Hoffmanna. Pre cheletropické reakcie sú dôležité nasledujúce body:
- Reakcia môže byť suprafaciálna alebo zahrnovať kombináciu suprafaciálneho/antarafaciálneho viazania v závislosti od fázového vzťahu interagujúcich orbitálov.
- Pre concertedné priebehy platia rovnaké princípy o zachovaní symetrie orbitálov ako pre iné pericyklické reakcie, takže zmena podmienok (tepelná vs. fotochemická) môže zmeniť povolené stereochemické dráhy.
Typické príklady
Medzi najčastejšie a najilustratívnejšie príklady cheletropických reakcií patria:
- Cyclopropanácia alkenov karbenmi – pri adícii singletného karbenu (:CH2 alebo substituovaný karben) na dvojitú väzbu alkenu vznikajú dve nové väzby medzi karbenovým uhlíkom a oboma uhlíkmi alkenu. Tento proces je typický príklad cheletropickej adície, často prebieha concertedne a býva stereospecifický (geometria alkenu sa prenáša do produktu).
- Adícia SO2 na konjugované dieny – napríklad reakcia 1,3-butadienu so sírovým oxidu vedie k tvorbe sulfolénov (2,5-dihydrothiophén 1,1-dioxidu). Túto reakciu možno považovať za cheletropickú [4+1] adíciu, kde sa dve väzby vytvoria na atóme síry.
- Cheletropické extrúzie malých molekúl – mnohé reakcie prechádzajú v oboch smeroch: adícia malého fragmentu (napr. CO alebo N2) a naopak extrúzia tohto fragmentu z cyklického systému. Extrúzia plynu (CO, N2) je silnou hnacou silou retrosyntetických alebo termodynamických procesov, pretože uvoľnenie plynu zvyšuje entropiu systému a často posúva rovnováhu k produktu.
Stereochémia a kinetika
Keď cheletropická reakcia prebieha concertedne, býva stereospecifická: konfigurácia východiskových látok sa premieta do konfigurácie produktov. Napríklad concertedná adícia singletných karbenov na cis- alebo trans-alkeny vedie k príslušným cis- alebo trans-cyklopropánom (zachovanie stereochemie). Naopak, ak je reakcia kroková a zahŕňa radikálové alebo tripletné medziľahlé štáty, stereochemická informácia môže byť stratená.
Rýchlosť a priebeh závisia od elektrónovej povahy substrátov (elektrón bohatejšie alkeny reagujú rýchlejšie s elektrofilnými karbenmi), od stavu karbenu (singlet vs. triplet) a od katalýzy (kovové karbenoidy, napr. s Rh alebo Cu, môžu meniť selektivitu a stereochemickú kontrolu). V syntéze sa preto používajú rôzne katalyzátory a ligandové prostredia na riadenie enantiomernej a diastereomernej selektivity pri cyklopropanáciách.
Význam v organickej syntéze
Cheletropické reakcie majú praktický význam v syntéze, pretože umožňujú vytvárať cyklické systémy (napr. cyklopropány), zavádzať heteroatómy do kruhov a efektívne odstraňovať malé stabilné fragmenty (CO, N2, SO2) pre posun rovnováhy či tvorbu nových väzieb. Sulfolény napríklad slúžia aj ako zdroj SO2 alebo ako chránené formy pre neskoršie chemické transformácie.
Variácie a výnimky
Nie všetky procesy, ktoré vedú k dvom novým väzbám na jednom atóme, sú nevyhnutne concertedné cheletropické reakcie; mechanizmus je experimentálne určený kinetikou, stereochemiou a niekedy aj výpočtami. Vplyv substituentov, rozpúšťadla, teploty a katalýzy môže viesť k zmene mechanizmu z concertedného na krokový alebo naopak.
Zhrnutie: cheletropické reakcie sú špecifickým a užitočným typom pericyklických procesov, v ktorých jeden atóm súčasne nadväzuje dve nové väzby. Ich porozumenie cez orbitalovú symetriu, stereochemické dôsledky a príklady (karbenové cyklopropanácie, adície SO2, extrúzie CO či N2) je dôležité pre plánovanie efektívnych syntetických postupov.

Obrázok 1. Pericyklické reakcie
Teoretická analýza
Vzhľadom na geometriu molekúl zapojených do cheletropických reakcií potvrdzujú viaceré predpovede teoretických chemikov. Cheletropické reakcie potvrdzujú zachovanie symetrie molekulových orbitálov.
V pericyklickom prechodnom stave malá molekula daruje kruhu dva elektróny. Reakciu možno vysvetliť dvoma možnými geometriami. Malá molekula sa môže priblížiť lineárnym alebo nelineárnym spôsobom. Pri lineárnom priblížení sú elektróny v orbitále malej molekuly nasmerované priamo na π systém veľkej molekuly. Pri nelineárnom priblížení sa orbitál približuje pod mierne vychýleným uhlom. Schopnosť π-systému rotovať pri približovaní sa malej molekuly je rozhodujúca pri vytváraní nových väzieb. Smer otáčania sa bude líšiť v závislosti od toho, koľko π-elektrónov je v systéme. Schéma dvojelektrónového fragmentu približujúceho sa k štvorelektrónovému π-systému pomocou hraničných molekulových orbitálov je znázornená nižšie. Rotácia bude disrotácia, ak sa malá molekula približuje lineárne, a konrotácia, ak sa molekula približuje nelineárne. Disrotácia a konrotácia hovorí o tom, ako rotujú väzby v π-systéme. Disrotácia znamená opačný smer, zatiaľ čo konrotácia znamená rovnaký smer. To je znázornené aj na nasledujúcom diagrame.
Pomocou Huckelovho pravidla možno určiť, či je π-systém aromatický alebo antiaromatický. Ak je aromatický, lineárne prístupy používajú disrotáciu, zatiaľ čo nelineárne prístupy používajú konrotáciu. Opačne je to v prípade antiaromatického systému. Lineárne prístupy budú mať konrotatórny pohyb, zatiaľ čo nelineárne prístupy budú mať disrotatórny pohyb.
Cheletropické reakcie zahŕňajúce SO2
Termodynamika
Pri reakcii oxidu siričitého s butadiénom a izoprénom vznikajú dva rôzne produkty. Mechanizmus reakcie určuje, čo vznikne. Je možný kinetický aj termodynamický produkt. Termodynamického produktu vzniká viac ako kinetického produktu. Kinetický produkt vzniká pri Dielsovej-Alderovej reakcii, zatiaľ čo pri cheletropickej reakcii vzniká termodynamicky stabilnejší produkt. Cheletropická cesta sa využíva viac, pretože pri nej vzniká stabilnejší adukt s päťčlenným kruhom. Na nasledujúcej schéme je znázornený rozdiel medzi týmito dvoma produktmi. Cesta vľavo znázorňuje termodynamický produkt, zatiaľ čo cesta vpravo znázorňuje kinetický produkt. Suarez a Sordo to ukázali v roku 1995. Ukázali to pomocou experimentov aj pomocou Gaussových výpočtov.
Kinetika
Jedným z príkladov sú cheletropické reakcie 1,3-diénov s oxidom siričitým. Chemici pozorne skúmali kinetiku tejto reakcie. V roku 1976 Isaacs a Laila merali kenetické faktory pre adíciu oxidu siričitého na deriváty butadiénu. Rýchlosti adície sledovali v benzéne pri 30 °C s počiatočným dvadsaťnásobným prebytkom diénu. Na meranie zániku SO2 použili spektrofotometer na štúdium svetla pri vlnovej dĺžke 320 nm. Reakcia vykazovala "pseudokinetiku prvého poriadku". Chemici zistili, že skupiny odoberajúce elektróny na diéne znižujú rýchlosť reakcie. Rýchlosť reakcie bola tiež výrazne ovplyvnená sterickými účinkami 2-substituentov, pričom objemnejšie skupiny zvyšovali rýchlosť reakcie. (Inými slovami, čím väčšia bola skupina atómov visiacich z druhého atómu uhlíka, tým rýchlejšie prebiehala reakcia.) Autori to pripisujú tendencii objemných skupín uprednostňovať cisoidnú konformáciu diénu, ktorá je pre reakciu nevyhnutná (pozri tabuľku nižšie). Okrem toho sa pre sedem diénov merali rýchlosti pri štyroch teplotách. Na základe týchto meraní chemici použili Arrheniovu rovnicu na výpočet aktivačnej entalpie (ΔH‡) a aktivačnej entropie (ΔS‡) pre každú reakciu. Išlo o jeden z prvých významných pokusov o štúdium kenetiky cheletropickej reakcie.
| -Butadién | 104 k /min−1 (30 °C) (± 1-2 %) absolútne | 104 k /min−1 (30 °C) (± 1-2 %) relatívne | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-metyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-etyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| 2-brómoetyl | 0.72 | 0.39 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| 2-(p-brómofenyl) | 9.07 | 4.96 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| 2,3-dimetyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metyl | 0.18 | 0.10 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| trans-1-metyl | 0.69 | 0.38 | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
| 1,2-dimetylén-cyklohexán | 24.7 | 13.5 | 11.4 | -16 |
| 2-metyl-1,1,4,4-d4 | 1.96 | NEUPLATŇUJE SA | NEUPLATŇUJE SA | NEUPLATŇUJE SA |
Monnat, Vogel a Sordo v roku 2002 merali kinetiku adície oxidu siričitého na 1,2-dimetylidénecykloalkány. Napísali, že reakcia 1,2-dimethylidenecyklohexánu s oxidom siričitým môže v závislosti od reakčných podmienok poskytovať dva rôzne produkty. Reakcia vytvára zodpovedajúci sultín prostredníctvom hetero-Diels-Alderovej reakcie pod kinetickou kontrolou (≤ -60 °C), ale pod termodynamickou kontrolou (≥ -40 °C) reakcia vytvára zodpovedajúci sulfolén prostredníctvom cheletropickej reakcie. Aktivačná entalpia pre hetero-Diels-Alderovu reakciu je približne o 2 kcal/mol menšia ako pre zodpovedajúcu cheletropickú reakciu. Sulfolén je približne o 10 kcal/mol stabilnejší ako izometrický sultín v roztoku CHCl/SO. 222
Autorom sa podarilo experimentálne vypracovať rýchlostný zákon pri 261,2 K pre reakciu 1,2-dimethylidenecyklohexánu s oxidom siričitým za vzniku príslušného sulfolénu. Reakcia prebiehala v prvom poriadku pre 1,2-dimethylidenecyklohexán, ale v druhom poriadku pre oxid siričitý (pozri ďalej). Tým sa potvrdila predpoveď teoretických chemikov založená na kvantových výpočtoch na vysokej úrovni ab initio. Pomocou výpočtových metód autori navrhli prechodovú štruktúru pre cheletropickú reakciu 1,2-dimetylidéncyklohexánu s oxidom siričitým (pozri obrázok vpravo). Reakcia je druhého rádu v oxide siričitom, pretože na prechodový stav sa pravdepodobne viaže ďalšia molekula oxidu siričitého, ktorá ho pomáha stabilizovať. Podobné výsledky sa zistili v štúdii Suareza, Sorda a Sorda z roku 1995, v ktorej sa použili ab initio výpočty na štúdium kinetickej a termodynamickej kontroly reakcie oxidu siričitého s 1,3-dienmi.
d [ ]3 d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}
Účinky rozpúšťadla
Vplyv rozpúšťadla na cheletropickú reakciu 3,4-dimetyl-2,5-dihydrotiofén-1,1-dioxidu (znázornené vpravo) sa kineticky skúmal v 14 rozpúšťadlách. Zistilo sa, že konštanty reakčnej rýchlosti priamej a spätnej reakcie okrem rovnovážnych konštánt lineárne korelujú so stupnicou polarity rozpúšťadla ET(30).
Reakcie prebiehali pri 120 °C a študovali sa pomocou 1H-NMR spektroskopie reakčnej zmesi. Zistilo sa, že rýchlosť k1 sa pri prechode od cyklohexánu k metanolu znižuje 4,5-krát. Zistilo sa, že reverzná rýchlosť k-1 sa pri prechode z cyklohexánu na metanol zvyšuje 53-násobne, zatiaľ čo rovnovážna konštanta Keq sa znižuje 140-násobne. Predpokladá sa, že počas procesu aktivácie dochádza k zmene polarity, čo dokazujú vzťahy medzi rovnovážnymi a kinetickými údajmi. Autori tvrdia, že reakcia je zrejme ovplyvnená polaritou rozpúšťadla, čo možno preukázať zmenou dipólových momentov pri prechode z reaktantu do prechodného stavu k produktu. Autori tiež uvádzajú, že cheletropická reakcia sa nezdá byť ovplyvnená kyslosťou ani zásaditosťou rozpúšťadla.
Na základe výsledkov tejto štúdie autori očakávajú nasledujúce správanie:
1. Zmena polarity rozpúšťadla ovplyvní rýchlosť menej ako rovnováha.
2. Rýchlostné konštanty sa budú vyznačovať opačným vplyvom na polaritu: k1 sa bude mierne znižovať so zvyšovaním ET(30) a k-1 sa bude zvyšovať za rovnakých podmienok.
3. Vplyv na k-1 bude väčší ako na k1.

Reakcia 1,2-dimetylidénecyklohexánu so SO2, pri ktorej vzniká sultín prostredníctvom heterodielsovej-Alderovej reakcie pod kinetickou kontrolou alebo sulfolén prostredníctvom cheletropickej reakcie pod termodynamickou kontrolou

Navrhovaný prechodný stav pre reakciu 1,2-dimetylidéncyklohexánu so SO2 za vzniku sulfolénu prostredníctvom cheletropickej reakcie
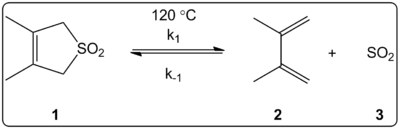
Cheletropická reakcia študovaná v rôznych rozpúšťadlách
Adície karbénov na alkény
Jednou zo synteticky najdôležitejších cheletropických reakcií je adícia singletového karbénu na alkén za vzniku cyklopropánu (pozri obrázok vľavo). Karbén je neutrálna molekula obsahujúca dvojmocný uhlík so šiestimi elektrónmi vo valenčnej škrupine. Z tohto dôvodu sú karbény vysoko reaktívne elektrofily a vznikajú ako medziprodukty reakcií. Singletný karbén obsahuje prázdny p orbitál a približne sp 2hybridný orbitál, ktorý má dva elektróny. Singletové karbény sa stereošpecificky pridávajú k alkénom a stereochémia alkénov sa zachováva v produkte cyklopropánu. Mechanizmus adície karbénu na alkén je koordinovaná [2+1] cykloadícia (pozri obrázok). Karbény získané z chloroformu alebo bromoformu sa môžu použiť na pridanie CX2 k alkénu za vzniku dihalocyklopropánu, zatiaľ čo Simmonsovo-Smithovo činidlo pridáva CH2.
Interakcia zaplneného karbénového orbitálu s alkénovým π systémom vytvára štvorelektrónový systém a podporuje nelineárny prístup. Priaznivé je aj miešanie prázdneho p orbitálu karbénu s vyplneným π orbitálom alkénu. K priaznivému miešaniu dochádza prostredníctvom nelineárneho prístupu (pozri obrázok 2 vpravo). Hoci teória jasne uprednostňuje nelineárny prístup, neexistujú žiadne zjavné experimentálne dôsledky pre lineárny a nelineárny prístup.

Pridanie karbénu k alkénu za vzniku cyklopropánu

Obrázok 2. A) Orbitály pre singletové karbény B) Nelineárny prístup a) sp2 orbitálu karbénu a b) p orbitálu karbénu
Otázky a odpovede
Otázka: Čo je to cheletropická reakcia?
Odpoveď: Cheletropická reakcia je typ pericyklickej reakcie, pri ktorej jeden atóm na jednom z činidiel získa dve nové väzby.
Otázka: Čo je to pericyklická reakcia?
Odpoveď: Pericyklická reakcia je reakcia, ktorá zahŕňa prechodný stav s cyklickým usporiadaním atómov a s ním spojeným cyklickým usporiadaním interagujúcich orbitálov, pri ktorej dochádza k reorganizácii väzieb َ a ً.
Otázka: Čím sa líši od iných typov reakcií?
Odpoveď: Cheletropické reakcie sú podtriedou cykloadícií a od ostatných typov reakcií sa líšia tým, že na jednom z činidiel sa vytvárajú obe nové väzby na ten istý atóm.
Otázka: Aké sú niektoré príklady?
Odpoveď: Medzi príklady patria "cheletropické extrúzie", napríklad keď jediný atóm v karbonylovej skupine skončí v oxide uhoľnatom.
Otázka: Čo je hnacou silou týchto reakcií?
Odpoveď: Hnacou silou týchto reakcií je často entropický prínos uvoľňovania plynu (napr. CO alebo N2).
Otázka: Súvisí obrázok 1 s cheletropickými reakciami? Odpoveď: Áno, na obrázku 1 sú uvedené príklady cheletropických reakcií.
Prehľadať
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)