Chemická kinetika: definícia, princípy a faktory ovplyvňujúce rýchlosť reakcií
Prehľad chemickej kinetiky: definícia, princípy a faktory ovplyvňujúce rýchlosť reakcií. Zistite, ako teplota, tlak, rozpúšťadlo a katalyzátory menia rýchlosť a mechanizmy.
Chemická kinetika, nazývaná aj reakčná kinetika, skúma, ako rýchlo prebiehajú chemické reakcie. Zahŕňa štúdium toho, ako rôzne podmienky, ako napríklad teplota, tlak alebo použité rozpúšťadlo, ovplyvňujú rýchlosť reakcie. Chemickú kinetiku možno použiť aj na zistenie reakčných mechanizmov a prechodových stavov. Okrem základného výskumu je dôležitá v priemysle (optimalizácia výrobných procesov), v environmentálnej chémii (rozklad znečisťujúcich látok) alebo v medicíne (stabilita liečív, metabolické dráhy).
Základné princípy
Základná myšlienka chemickej kinetiky sa nazýva teória zrážok. Tá hovorí, že aby reakcia prebehla, musia sa molekuly navzájom zraziť a mať pri tom dostatočnú energiu a vhodnú orientáciu. Spôsoby zvyšovania rýchlosti reakcie preto musia zvyšovať počet úspešných nárazov alebo pravdepodobnosť, že zrážka vedie k produktu. To sa dá dosiahnuť mnohými spôsobmi:
- zvýšením koncentrácie reaktantov (viac častíc → viac zrážok),
- zvýšením teploty (viac častíc dosahuje aktivačnú energiu),
- zmenou rozpúšťadla alebo jeho vlastností (ovplyvníer solváciu a stabilitu prechodového stavu),
- zvýšením povrchovej plochy pevnej fázy pri heterogénnych reakciách (jemnejší prášok, väčší kontakt),
- použitím katalyzátora, ktorý znižuje aktivačnú energiu bez spotreby v celkovej reakcii.
Rýchlostné zákony a ich určenie
Pomocou experimentov je možné vypočítať reakčné rýchlosti, z ktorých možno získať rýchlostné zákony a rýchlostné konštanty. Rýchlostný zákon je matematický výraz, pomocou ktorého môžete vypočítať rýchlosť reakcie vzhľadom na koncentráciu činidiel. Typický tvar pre reakciu A + B → produkty je:
v = k [A]^m [B]^n,
kde k je rýchlostná konštanta, m a n sú empirické exponenty určujúce poradie reakcie podľa jednotlivých látok. Poradie reakcie nemusí zodpovedať stechiometrii mechanizmu; určuje sa experimentálne (metódy: metóda počiatočných rýchlostí, integračné metódy, izolované reakcie atď.).
Pre jednoduché príklady integrovateľných rýchlostných zákonov:
- nulový rad: [A] = [A]0 − kt (rýchlosť nezávisí od koncentrácie),
- prvý rad: ln[A] = ln[A]0 − kt (typické pre rozpad alebo unimolekulárne procesy),
- druhý rad: 1/[A] = 1/[A]0 + kt (často pri dimerizáciách alebo bimolekulárnych procesoch).
Polčas rozkladu (t1/2) je užitočná veličina: pre prvý rad je nezávislý od počiatočnej koncentrácie, pre druhý rad závisí a pod. Určenie rýchlostných konštánt sa často vykonáva spektrofotometriou, kalorimetriou, konduktometriou alebo chromatografiou v závislosti od povahy látok.
Aktivačná energia a teplotný efekt
Rýchlostná konštanta k závisí výrazne od aktivačnej energie Ea. Závislosť tabuluje Arrheniova rovnica:
k = A exp(−Ea / (RT)),
kde A je pre-exponenciálny faktor, R plynová univerzálna konštanta a T absolútna teplota. Vyššia teplota zvyšuje podiel molekúl s energiou nad Ea, takže reakcia prebieha rýchlejšie. Ako hrubé pravidlo sa často uvádza, že zvýšenie teploty o 10 °C môže zdvojnásobiť až strojnásobiť rýchlosť reakcie, ale presný faktor závisí od Ea.
Mechanizmy reakcií a kinetická analýza
Kinetika pomáha rozlišovať medzi elementárnymi krokmi reakčného mechanizmu a celkovým súhrnným priebehom reakcie. Pojmy, ktoré sa pri tom používajú:
- elementárny stupeň – jednoduchý krok s určitým molekularitným číslom (unimolekulárny, bimolekulárny),
- molekularita – počet častíc zúčastnených na elementárnom stupni,
- prechodový stav a teória prechodového stavu – popis energetickej bariéry a konfigurácie v bode maximálnej energie,
- metódy aproximácie – napr. steady-state (stacionárny stav) alebo pre-equilibrium prístupy, ktoré umožnia odvodiť pozorovaný rýchlostný zákon z mechanizmu.
Faktory ovplyvňujúce rýchlosť reakcií
Hlavné faktory, ktoré kinetiku ovplyvňujú:
- koncentrácia reaktantov (viac častíc → viac zrážok),
- teplota (ovplyvňuje rozdelenie kinetických energií),
- tlak (zvlášť významný u plynných systémov; vyšší tlak zvyšuje efektívne koncentrácie),
- rozpúšťadlo (polarita, viskozita a solvátové efekty menia energetiku prechodového stavu),
- povrchová plocha pri heterogénnych reakciách (kontaktné procesy na katalyzátoroch),
- katalyzátory (homogénne alebo heterogénne) – znižujú aktivačnú energiu a menia mechanizmus,
- ionická sila roztoku, prítomnosť inhibítorov alebo promotérov, a v niektorých prípadoch svetlo (fotochemické reakcie).
Praktické metódy a aplikácie
V praxi sa kinetické štúdie využívajú na:
- navrhovanie a optimalizáciu priemyselných procesov (zvýšenie výťažku pri danej rýchlosti),
- určenie životnosti a stabilnosti látok (farmakológia, materiálová chémia),
- pochopenie environmentálnych premien (rozklad znečisťujúcich látok),
- vývoj katalyzátorov a štúdium ich mechanizmu,
- kontrolu a modelovanie reakčných sietí v biochemických a metabolických dráhach.
Zhrnutie: Chemická kinetika spája experimenty a teóriu, aby vysvetlila, prečo a ako rýchlo sa vykonávajú chemické reakcie. Analýza rýchlostných zákonov, závislosti od koncentrácie, teploty a ďalších faktorov spolu s modelovaním mechanizmov umožňuje predpovedať a riadiť reakčné procesy v laboratóriu aj v priemysle.
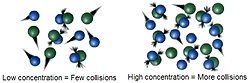
Pri vyššej koncentrácii do seba molekuly ľahšie narážajú, a preto je rýchlosť reakcie väčšia.
Poradie reakcie
rovnováha má dynamický charakter
Existuje mnoho typov zákonov o sadzbách, ale najčastejšie sa používajú tieto:
- reakcia nulového poriadku: rýchlosť nezávisí od koncentrácie
- reakcia prvého rádu: rýchlosť závisí od koncentrácie len jedného reaktantu
- reakcia druhého rádu: rýchlosť závisí od koncentrácie dvoch reaktantov alebo od koncentrácie jedného reaktantu na druhú.
Na základe týchto údajov je možné uvažovať o mechanizme reakcie. Ak je napríklad druhého rádu, potom je pravdepodobné, že obe molekuly v reakcii sa spájajú počas kroku určujúceho rýchlosť. Tento krok je v mechanizme najťažší, pretože má najvyššiu aktivačnú energiu.
| · v · t · e Základné reakčné mechanizmy | |
| Nukleofilná substitúcia | Jednomolekulárna nukleofilná substitúcia (NS1) - Bimolekulárna nukleofilná substitúcia (NS2) - Nukleofilná aromatická substitúcia (NSAr) - Nukleofilná vnútorná substitúcia (NSi) |
| Jednomolekulová eliminácia (E1) - E1cB eliminačná reakcia - Bimolekulová eliminácia (E2) | |
| Elektrofilná adícia - Nukleofilná adícia - Adícia voľných radikálov - Cykloadícia | |
| Súvisiace témy | Elementárna reakcia - Molekularita - Stereochémia - Katalýza - Teória zrážok - Účinky rozpúšťadla - Tlačenie šípok |
| Chemická kinetika | |
Otázky a odpovede
Otázka: Čo je to chemická kinetika?
Odpoveď: Chemická kinetika, nazývaná aj reakčná kinetika, je štúdium toho, ako rýchlo prebiehajú chemické reakcie a ako rôzne podmienky, napríklad teplota, tlak alebo použité rozpúšťadlo, ovplyvňujú rýchlosť reakcie.
Otázka: Čo uvádza teória zrážok?
Odpoveď: Kolízna teória hovorí, že aby reakcia prebehla, molekuly sa musia navzájom zraziť. Spôsoby zvyšovania rýchlosti reakcie preto musia zvyšovať počet nárazov.
Otázka: Ako môžete vypočítať reakčné rýchlosti?
Odpoveď: Pomocou experimentov je možné vypočítať reakčné rýchlosti, z ktorých môžete získať rýchlostné zákony a rýchlostné konštanty.
Otázka: Čo je to rýchlostný zákon?
Odpoveď: Rýchlostný zákon je matematický výraz, pomocou ktorého môžete vypočítať rýchlosť reakcie vzhľadom na koncentráciu činidiel.
Otázka: Ako môžete zvýšiť rýchlosť reakcie?
Odpoveď: Rýchlosť reakcie možno zvýšiť zvýšením počtu zrážok medzi molekulami. To sa dá dosiahnuť mnohými spôsobmi, napríklad zmenou teploty, tlaku alebo použitého rozpúšťadla.
Otázka: Čo sú to prechodné stavy?
Odpoveď: Prechodné stavy sú medzistupne v chemických reakciách, ktoré vznikajú, keď reaktanty tvoria produkty a počas tohto procesu sa uvoľňuje alebo absorbuje energia.
Prehľadať