SN2 reakcia
Reakcia SN 2 (známa aj ako bimolekulárna nukleofilná substitúcia) je substitučná reakcia v organickej chémii. Je to typ nukleofilnej substitúcie, pri ktorej osamelý pár nukleofilu atakuje elektrónovo deficitné elektrofilné centrum a viaže sa naň. Tým sa vylúči ďalšia skupina nazývaná "odchádzajúca skupina". Prichádzajúca skupina teda v jednom kroku nahradí odchádzajúcu skupinu. Keďže v pomalom, rýchlosť určujúcom kroku reakcie sa zúčastňujú dva reagujúce druhy, vedie to k názvu bimolekulárna nukleofilná substitúcia alebo SN 2. Medzi anorganickými chemikmi je reakcia SN 2 často známa ako výmenný mechanizmus.
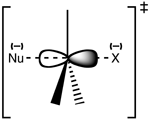
Štruktúra prechodového stavu SN 2
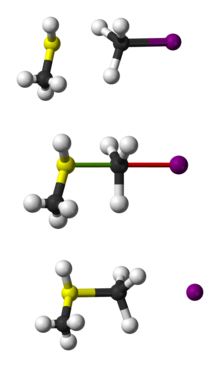
Guľôčkové znázornenie reakcie SN 2 CH3 SH s CH3 I
Mechanizmus reakcie
Reakcia najčastejšie prebieha na alifatickom sp3 uhlíkovom centre, ku ktorému je pripojená elektronegatívna, stabilná odchádzajúca skupina - "X" - často halogenidový atóm. K prerušeniu väzby C-X a vzniku novej väzby C-Nu dochádza súčasne za vzniku prechodného stavu, v ktorom je nukleofilne atakovaný uhlík pentakoordinovaný a približne sp2 hybridizovaný. Nukleofil útočí na uhlík pod uhlom 180° k odchádzajúcej skupine, pretože to poskytuje najlepšie prekrývanie medzi osamelým párom nukleofilu a antiväzbovým orbitálom C-X σ*. Odchádzajúca skupina je potom vytlačená z opačnej strany a vzniká produkt.
Ak je substrát, na ktorý sa nukleofilne útočí, chirálny, môže to viesť, hoci nie nevyhnutne, k inverzii stereochémie, nazývanej Waldenova inverzia.
V príklade reakcie SN 2 je výsledkom útoku OH −(nukleofil) na brómoetán (elektrofil) etanol, pričom bromid sa vylúči ako odchádzajúca skupina:
Reakcia SN 2 nastáva, ak zadná strana cesty útoku nie je blokovaná inými atómami v molekule (stericky brzdená substituentmi na substráte). Tento mechanizmus sa teda zvyčajne vyskytuje na neblokovanom primárnom uhlíkovom centre. Ak je na substráte v blízkosti odchádzajúcej skupiny sterická prekážka, napríklad na terciárnom uhlíkovom centre, substitúcia bude využívať skôr mechanizmus SN 1 ako SN 2 (SN 1 by bol pravdepodobnejší aj pri blokovaných molekulách, pretože by mohol vzniknúť dostatočne stabilný karbokačný intermediát).
V koordinačnej chémii prebieha asociatívna substitúcia podobným mechanizmom ako SN 2.
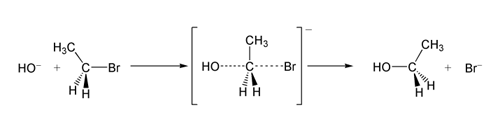
SN 2 reakcia brómoetánu s hydroxidovým iónom.
Faktory ovplyvňujúce rýchlosť reakcie
Rýchlosť reakcie ovplyvňujú štyri faktory:
- Substrát. Substrát zohráva najdôležitejšiu úlohu pri určovaní rýchlosti reakcie. Je to preto, že nukleofil útočí zo zadnej strany substrátu, čím sa preruší väzba medzi uhlíkom a odchádzajúcou skupinou a vytvorí sa väzba medzi uhlíkom a nukleofilom. Preto, aby sa maximalizovala rýchlosť reakcie SN 2, musí byť zadná strana substrátu čo najmenej obmedzovaná. Celkovo to znamená, že najrýchlejšie reagujú metylové a primárne substráty, po ktorých nasledujú sekundárne substráty. Terciárne substráty sa nezúčastňujú reakcií SN 2 z dôvodu sterických prekážok.
- Nukleofil. Podobne ako substrát, aj sterická prekážka ovplyvňuje silu nukleofilu. Napríklad metoxidový anión je silnou bázou aj nukleofilom, pretože je metylovým nukleofilom, a preto je veľmi málo brzdený. Na druhej strane terc-butoxid je silná zásada, ale slabý nukleofil, pretože jeho tri metylové skupiny bránia jeho prístupu k uhlíku. Sila nukleofilu je ovplyvnená aj nábojom a elektronegativitou: nukleofilita sa zvyšuje s rastúcim záporným nábojom a klesajúcou elektronegativitou. Napríklad OH- je lepší nukleofil ako voda a I- je lepší nukleofil ako Br- (v polárnych protických rozpúšťadlách). V polárnom aprotickom rozpúšťadle sa nukleofilita zvyšuje o stĺpec periodickej tabuľky, pretože medzi rozpúšťadlom a nukleofilom nie je vodíková väzba. V tomto prípade nukleofilita odráža zásaditosť. I- by preto bol slabším nukleofilom ako Br- , pretože je slabšou zásadou.
- Rozpúšťadlo. Rozpúšťadlo ovplyvňuje rýchlosť reakcie, pretože rozpúšťadlá môžu, ale nemusia obklopovať nukleofil, a tak brániť alebo nebrániť jeho prístupu k atómu uhlíka. Polárne aprotické rozpúšťadlá, ako napríklad tetrahydrofurán, sú pre túto reakciu lepšími rozpúšťadlami ako polárne protické rozpúšťadlá, pretože polárne protické rozpúšťadlá budú rozpúšťané vodíkovou väzbou rozpúšťadla s nukleofilom. To mu bráni v útoku na uhlík s odchádzajúcou skupinou.
- Odchod zo skupiny. Odchádzajúca skupina ovplyvňuje rýchlosť reakcie. Čím je odchádzajúca skupina stabilnejšia, tým je pravdepodobnejšie, že pri útoku nukleofilu na uhlík si vezme so sebou dva elektróny väzby odchádzajúcej skupiny. Preto čím slabšia je ponechávajúca skupina ako konjugovaná báza, tým lepšia je ponechávajúca skupina. Podobne, čím silnejšia je jej zodpovedajúca kyselina, tým lepšia je odchádzajúca skupina. Príkladmi dobrých odlučovacích skupín sú halogenidy (okrem fluoridu) a tosylát. Ale HO- a H2 N- nie sú dobré odlučovače.
Kinetika reakcie
Rýchlosť reakcie SN 2 je druhého rádu, keďže krok určujúci rýchlosť závisí od koncentrácie nukleofilu [Nu− ], ako aj od koncentrácie substrátu [RX].
r = k[RX][Nu− ]
Toto je kľúčový rozdiel medzi mechanizmami SN 1 a SN 2. V reakcii SN 1 nukleofil útočí po skončení kroku obmedzujúceho rýchlosť. Pri reakcii SN 2 však nukleofil vytláča odchádzajúcu skupinu v limitujúcom kroku. Inými slovami, rýchlosť reakcie SN 1 závisí len od koncentrácie substrátu, zatiaľ čo rýchlosť reakcie SN 2 závisí od koncentrácie substrátu aj nukleofilu. V prípadoch, keď sú možné oba mechanizmy (napríklad pri sekundárnom uhlíkovom centre), mechanizmus závisí od rozpúšťadla, teploty, koncentrácie nukleofilu alebo od odchádzajúcej skupiny.
SN 2 reakcie sú vo všeobecnosti preferované v primárnych alkylhalogenidoch alebo sekundárnych alkylhalogenidoch s aprotickým rozpúšťadlom. V terciárnych alkylhalogenidoch prebiehajú v zanedbateľnej miere v dôsledku sterických prekážok.
SN 2 a SN 1 sú dva extrémy kĺzavej stupnice reakcií. Je možné nájsť mnoho reakcií, ktoré vo svojich mechanizmoch vykazujú charakter SN 2 aj SN 1. Napríklad je možné získať kontaktné iónové páry vytvorené z alkylhalogenidu, v ktorých ióny nie sú úplne oddelené. Keď tieto podliehajú substitúcii, stereochémia bude invertovaná (ako v SN 2) pre mnohé reagujúce molekuly, ale niekoľko z nich môže vykazovať zachovanie konfigurácie. Reakcie SN 2 sú častejšie ako reakcie SN 1.
Súťaž E2
Častou vedľajšou reakciou, ktorá prebieha pri reakciách SN 2, je eliminácia E2: prichádzajúci anión môže pôsobiť skôr ako báza než ako nukleofil, pričom odstráni protón a vedie k vzniku alkénu. Tento efekt možno demonštrovať na reakcii v plynnej fáze medzi sulfonátom a jednoduchým alkylbromidom, ktorá prebieha v hmotnostnom spektrometri:

Pri etylbromide je reakčným produktom prevažne substitučný produkt. S rastúcou sterickou prekážkou okolo elektrofilného centra, ako je to v prípade izobutylbromidu, sa substitúcia nepodporuje a prevládajúcou reakciou je eliminácia. Ďalšími faktormi, ktoré podporujú elimináciu, sú sila bázy. S menej zásaditým benzoátovým substrátom reaguje izopropylbromid s 55 % substitúciou. Vo všeobecnosti reakcie v plynnej fáze a reakcie v roztokovej fáze tohto typu sledujú rovnaké trendy, aj keď v prvom prípade odpadá vplyv rozpúšťadla.
Mechanizmus kruhového objazdu
Vývoj, ktorý vzbudil pozornosť v roku 2008, sa týka okružného mechanizmu SN 2 pozorovaného v reakcii medzi chloridovými iónmi a metyljodidom v plynnej fáze pomocou špeciálnej techniky nazývanej zobrazovanie skríženými molekulovými lúčmi. Keď majú chloridové ióny dostatočnú rýchlosť, energia výsledných jodidových iónov po zrážke je oveľa nižšia, ako sa očakávalo, a teoreticky sa predpokladá, že energia sa stráca v dôsledku úplného obtočenia metylovej skupiny okolo atómu jódu predtým, ako dôjde k vlastnému premiestneniu.
Súvisiace stránky
- Substitučná reakcia
- SN 1 reakcia
Otázky a odpovede
Otázka: Čo je reakcia SN2?
Odpoveď: Reakcia SN2 je substitučná reakcia v organickej chémii, pri ktorej nukleofil útočí na elektrofilné centrum s nedostatkom elektrónov, pričom vytláča odchádzajúcu skupinu a potom ju v jednom kroku nahrádza.
Otázka: Aký druh substitučnej reakcie je reakcia SN2?
Odpoveď: Reakcia SN2 je typ nukleofilnej substitučnej reakcie.
Otázka: Koľko reagujúcich druhov sa zúčastňuje na pomalom, rýchlosť určujúcom kroku reakcie SN2?
Odpoveď: Na pomalom kroku reakcie SN2, ktorý určuje rýchlosť, sa zúčastňujú dva reakčné druhy.
Otázka: Čo znamená názov "bimolekulárna nukleofilná substitúcia" pre reakciu SN2?
Odpoveď: Názov "bimolekulárna nukleofilná substitúcia" pre reakciu SN2 odkazuje na skutočnosť, že na pomalom, rýchlosť určujúcom kroku reakcie sa podieľajú dva reagujúce druhy.
Otázka: Čo je nukleofil v kontexte reakcie SN2?
Odpoveď: Nukleofil je molekula alebo ión, ktorý odovzdáva osamelý pár elektrónov na vytvorenie chemickej väzby.
Otázka: Čo je elektrofil v kontexte reakcie SN2?
Odpoveď: Elektrofil je molekula alebo ión, ktorý prijíma pár elektrónov na vytvorenie chemickej väzby.
Otázka: Ako sa reakcia SN2 často nazýva medzi anorganickými chemikmi?
Odpoveď: Medzi anorganickými chemikmi je reakcia SN2 často známa ako výmenný mechanizmus.
Prehľadať