Karbokatión (carbocation) — definícia, štruktúra, stabilita a reaktivita
Karbokatión (carbocation) — jasná definícia, štruktúra, hybridizácia, faktory stability a reaktivita. Praktický prehľad pre študentov a chemikov.
Karbocation je ión s kladne nabitým atómom uhlíka. Nabitý atóm uhlíka v karbokacióne má často len šesť elektrónov vo vonkajšej valenčnej škrupine namiesto plného oktetu; preto sa hovorí o „sextete“. Podľa pravidla oktetu sú atómy s ôsmimi valenčnými elektrónmi najstabilnejšie, a preto sa karbokátiony správajú ako veľmi reaktívne medziprodukty — snažia sa získať späť plný oktet a neutrálny náboj.
Štruktúra a hybridizácia
Aj keď by jednoduchá logika mohla naznačovať, že karbokátiony majú sp3 hybridizáciu s „prázdnym“ sp3 orbitálom, experimenty a výpočty ukazujú, že väčšina stabilných karbokátionov je sp2 hybridizovaná a planárna. To znamená, že nabitý uhlík má trigónálne planárnu geometriu a neobsadený p-orbitál kolmý na rovinu väzieb; práve tento prázdny p-orbitál prijíma elektróny pri nukleofilných útokoch.
Faktory ovplyvňujúce stabilitu
- Hyperkonjugácia: alkylové skupiny môžu delokalizovať kladný náboj cez σ–C–H väzby, čo stabilizuje kation. Preto platí poradie stability: terc. > sek. > prim. > metyl.
- Indukčný efekt: skupiny s elektron-donorovými vlastnosťami (napr. alkyly) znižujú koncentráciu kladného náboja na uhlíku.
- Rezónančná delokalizácia: ak je kation susediaci s π-systémom (napr. benzylický alebo allylický karbokátion), náboj sa delokalizuje na viaceré atómy a kation je výrazne stabilizovaný.
- Elektróny darujúce substituenty: skupiny ako -OR alebo -NR2 môžu stabilizovať kation rezonančne alebo induktívne.
- Geometria a napätie: štrukturálne obmedzenia (napr. mostíkové alebo „non‑classical“ kationy) môžu viesť k neobvyklým delokalizovaným riešeniam, ktoré sú menej alebo viac stabilné podľa prípadu.
Druhy karbokátionov
- Alkylové: metylový, primárny, sekundárny, terciárny (stabilita podľa hyperkonjugácie).
- Benzylické a allylické: silne stabilizované rezonančnou delokalizáciou.
- Vinylové a arylové: vo všeobecnosti veľmi nestabilné, pretože kladný náboj nie je ľahko delokalizovateľný v rámci hybridizácie uhlíkového centra.
- Mostíkové alebo „non‑classical“ kationy: kedy je kladný náboj delokalizovaný cez viacero väzieb (príklad: norbornylový kation), historicky kontroverzný, dnes dobre študovaný prípad elektronickej delokalizácie.
Vznik a typické reakcie
Karbokationy sa tvoria bežne pri reakciách zahŕňajúcich heterolytické štiepenie väzby C–X (napr. odštiepenie halogenidu pri SN1), protónovaní alkenov (pri elektrofilnej adícii), pri reakciách E1 alebo pri hydride/alkylových preskokoch (rearrangements). Po svojom vzniku karbokátiony podliehajú:
- nukleofilnému útoku — vznik nových väzieb (napr. SN1),
- eliminácii (E1) — tvorba alkenov,
- rearrangements (hydridové alebo alkylové preskoky) — za účelom vytvorenia stabilnejšieho kationu,
- trappingu alebo adícii rozpúšťadla pri donorech elektrónov.
Experimentálna detekcia a životnosť
Väčšina karbokátionov sú krátkožijúce medziprodukty; ich prítomnosť sa preukazuje nepriamymi metódami (produktová analýza, stereochemické dôkazy) alebo priamymi technikami pri nízkych teplotách: nízkoteplotná NMR, kryogénne podmienky, infračervená spektroskopia a hmotnostná spektrometria. V niektorých prípadoch (silne stabilizované rezonančné kationy alebo pri dostatočnej stabilizácii rozpúšťadlom) je možné pozorovať karbokationy priamo.
Historické poznámky a moderný pohľad
Diskusia o „klasických“ vs. „neklasických“ (mostíkových) karbokátionoch bola dôležitá pre vývoj organickej chémie. Moderné experimentálne a výpočtové metódy ukázali, že mnohé prípady non‑classical charakteru sú skôr prípadmi silnej delokalizácie náboja než úplného rozdelenia väzieb — to mení naše chápanie a pomáha lepšie predpovedať reaktivity.
Reaktivita karbokationov je teda riadená ich štruktúrou a stabilitou: čím je kation stabilnejší (hyperkonjugácia, rezónancia, indukčné efekty), tým je pravdepodobnejšie, že sa bude správať ako izolovateľný alebo dlhšie trvajúci medziprodukt a tým sa mení pomer medzi možnými reakčnými cestami (nukleofilný útok vs. eliminácia vs. rearrangement).
Stručne: karbokátiony sú kľúčové a univerzálne medziprodukty v organickej chémii — ich pochopenie (štruktúra, faktory stabilizácie a reakčná schopnosť) je nevyhnutné pri predpovedaní výsledkov mnohých reakcií.
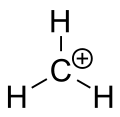
Karbéniový ión metánu

terc-butylový katión, preukazujúci planárnu geometriu
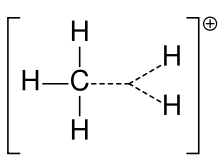
Karbóniový ión metánu
Definície
Karbocation sa predtým často nazýval karbóniový ión, ale chemici spochybňujú jeho presný význam. V súčasnej chémii je karbokación akýkoľvek kladne nabitý atóm uhlíka. Boli navrhnuté dva špeciálne typy: karbéniové ióny sú trojmocné a karbóniové ióny sú päťmocné alebo šesťmocné. V učebniciach na univerzitnej úrovni sa o karbokatiónoch hovorí len ako o karbéniových iónoch, alebo sa o karbokatiónoch hovorí s letmým odkazom na staršie slovné spojenie karbéniový ión alebo karbéniové a karbóniové ióny. Jedna učebnica dodnes zostáva pri staršom názve karbéniový ión pre karbéniový ión a výraz hypervalentný karbéniový ión vyhradzuje pre CH5+.
História
V roku 1891 G. Merling oznámil, že k tropylidénu (cykloheptatriénu) pridal bróm a potom produkt zahrial, čím získal kryštalický, vo vode rozpustný materiál C
7H
7Br. Nenavrhol jeho štruktúru, avšak Doering a Knox presvedčivo dokázali, že ide o tropylium (cykloheptatriénium) bromid. Podľa Hückelovho pravidla sa predpokladá, že tento ión je aromatický.
V roku 1902 Norris a Kehrman nezávisle od seba zistili, že bezfarebný trifenylmetanol dáva v koncentrovanej kyseline sírovej sýtožlté roztoky. Trifenylmetylchlorid podobne tvoril oranžové komplexy s chloridmi hliníka a cínu. V roku 1902 Adolf von Baeyer rozpoznal, že vzniknuté zlúčeniny majú charakter soli.
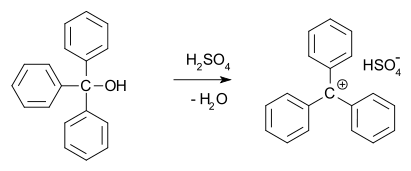
Vzťah medzi farbou a tvorbou soli nazval halochrómiou, ktorej najlepším príkladom je malachitová zeleň.
Karboxyláty sú reaktívne medziprodukty v mnohých organických reakciách. Túto myšlienku, ktorú prvýkrát navrhol Julius Stieglitz v roku 1899, ďalej rozvinul Hans Meerwein vo svojej štúdii Wagner-Meerweinovej prestavby z roku 1922. Zistilo sa, že karboxyláty sa zúčastňujú aj na reakcii NS1, reakcii E1 a na reakciách preskupenia, ako je Whitmorov posun 1,2. Chemický establišment sa zdráhal prijať pojem karbocation a časopis Journal of the American Chemical Society dlho odmietal články, ktoré sa o nich zmieňovali.
Prvé NMR spektrum stabilného karbokácie v roztoku publikovali Doering a spol. v roku 1958. Išlo o heptametylbenzéniový ión, ktorý vznikol pôsobením hexametylbenzénu s metylchloridom a chloridom hlinitým. Stabilný 7-norbornadenylový katión pripravili Story a spol. v roku 1960 reakciou norbornadenylchloridu s tetrafluoroboranom strieborným v oxide siričitom pri -80 °C. NMR spektrum ukázalo, že ide o neklasicky premosťovaný ión (prvý pozorovaný stabilný neklasický ión).
V roku 1962 Olah priamo pozoroval terc-butylkarbocation pomocou jadrovej magnetickej rezonancie ako stabilný druh pri rozpúšťaní terc-butylfluoridu v kyseline magickej. NMR norbornylového katiónu prvýkrát zaznamenali Schleyer a spol. a Saunders a spol. ukázali, že podlieha protónovej skramblácii cez bariéru.
Vlastnosti
V organickej chémii je karbokatión často cieľom nukleofilného útoku nukleofilov, ako sú hydroxylové (OH−) ióny alebo halogénové ióny.
Karboxyláty sa klasifikujú ako primárne, sekundárne alebo terciárne v závislosti od počtu atómov uhlíka viazaných na ionizovaný uhlík. Primárne karboxyty majú k ionizovanému uhlíku pripojený jeden alebo nula uhlíkov, sekundárne karboxyty majú k ionizovanému uhlíku pripojené dva uhlíky a terciárne karboxyty majú k ionizovanému uhlíku pripojené tri uhlíky.
Stabilita karbokacionu sa zvyšuje s počtom alkylových skupín viazaných na uhlík nesúci náboj. Terciárne karboxy sú stabilnejšie (a tvoria sa ľahšie) ako sekundárne karboxy; primárne karboxy sú veľmi nestabilné, pretože zatiaľ čo ionizované uhlíky vyššieho rádu sú stabilizované hyperkonjugáciou, nesubstituované (primárne) uhlíky nie sú. Preto reakcie ako reakcia NS1 a eliminačná reakcia E1 zvyčajne nenastanú, ak by sa vytvoril primárny karbokacion. Výnimka nastáva vtedy, keď je vedľa ionizovaného uhlíka dvojitá väzba uhlík-uhlík. Takéto katióny ako allylový katión CH=CH-CH22+ a benzylový katión6 CH-CH52+ sú stabilnejšie ako väčšina ostatných karboxylov. Molekuly, ktoré môžu tvoriť allylové alebo benzylové karboxyty, sú obzvlášť reaktívne.
Karboxyláty podliehajú reakciám preskupenia z menej stabilných štruktúr na rovnako stabilné alebo stabilnejšie štruktúry s konštantami rýchlosti presahujúcimi 10/s9. Táto skutočnosť komplikuje syntetické cesty k mnohým zlúčeninám. Napríklad pri zahrievaní 3-pentanolu s vodnou HCl sa pôvodne vytvorený 3-pentylový karbokacion preskupí na štatistickú zmes 3-pentylu a 2-pentylu. Tieto katióny reagujú s chloridovým iónom za vzniku približne 1/3 3-chlórpentánu a 2/3 2-chlórpentánu.
Niektoré karboxyty, ako napríklad norbornylový katión, vykazujú viac-menej symetrickú trojcentrickú väzbu. Katióny tohto druhu sa označujú ako neklasické ióny. Energetický rozdiel medzi "klasickými" karbokatiónmi a "neklasickými" izomérmi je často veľmi malý a pri prechode medzi "klasickou" a "neklasickou" štruktúrou je vo všeobecnosti malá aktivačná energia, ak vôbec nejaká. "Neklasická" forma 2-butylového karbokaátu je v podstate 2-butén s protónom priamo nad stredom dvojitej väzby uhlík-uhlík. "Neklasické" karboxylácie boli kedysi predmetom veľkých sporov. Jedným z najväčších prínosov Georgea Olaha pre chémiu bolo vyriešenie tejto kontroverzie.
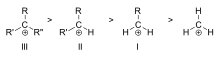
Poradie stability príkladov terciárnych (III), sekundárnych (II) a primárnych (I) alkylkarboxylov
Špecifické karboxyláty
Cyklopropylkarbinylkatióny možno študovať pomocou NMR:
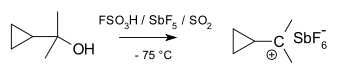
V NMR spektre dimetylderivátu sa nachádzajú dva neekvivalentné signály pre dve metylové skupiny, čo naznačuje, že molekulová konformácia tohto katiónu nie je kolmá (ako v A), ale je rozdvojená (ako v B) s prázdnym p-orbitalom a systémom cyklopropylového kruhu v rovnakej rovine:
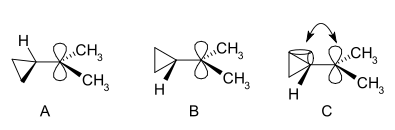
Z hľadiska teórie ohnutých väzieb sa táto preferencia vysvetľuje predpokladom priaznivého prekrývania orbitálov medzi naplnenými ohnutými väzbami cyklopropánu a prázdnym p-orbitalom.
Otázky a odpovede
Otázka: Čo je to karbocation?
Odpoveď: Karbocation je ión s kladne nabitým atómom uhlíka.
Otázka: Aká je vonkajšia valenčná škrupina karbokácie?
Odpoveď: Vonkajšia valenčná škrupina karbokácie má len šesť elektrónov namiesto stabilných ôsmich valenčných elektrónov.
Otázka: Prečo sú karbokatióny často reaktívne?
Odpoveď: Karboxyláty sú často reaktívne, pretože sa snažia zaplniť oktet valenčných elektrónov, ako aj získať neutrálny náboj.
Otázka: Aká je maximálna stabilita atómov uhlíka?
Odpoveď: Maximálna stabilita atómov uhlíka sa dosiahne, keď majú osem valenčných elektrónov.
Otázka: Čo je to sextet v chémii?
Odpoveď: Sextet je termín používaný na označenie atómu uhlíka v karbokacióne, ktorý má vo vonkajšej valenčnej škrupine len šesť elektrónov namiesto stabilných ôsmich valenčných elektrónov.
Otázka: Čo je to hybridizácia a molekulová geometria karbokácie?
Odpoveď: Hoci logika by naznačovala, že karbokácie majú hybridizáciu sp3 s prázdnym orbitálom sp3, ktorý dáva kladný náboj, ich reaktivita sa viac podobá hybridizácii sp2 s trigonálnou rovinnou molekulovou geometriou.
Otázka: Čo je oktetové pravidlo?
Odpoveď: Oktetové pravidlo je princíp v chémii, ktorý hovorí, že atómy majú tendenciu vytvárať chemické väzby s inými atómami, ktoré umožňujú, aby oba atómy mali stabilný súbor ôsmich valenčných elektrónov.
Prehľadať